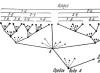
Рис. 8. Броуновское движение
Атомно-молекулярное учение имело огромное значение для химии, которая благодаря ему стала быстро развиваться и в короткое время достигла блестящих успехов.
Однако в конце XIX в., когда это учение дало уже столько ценных результатов возникло реакционное течение, в корне отрицавшее само существование атомов и молекул. Под влиянием идеалистической философии в Германии появилась так называемая «энергетическая» школа химиков, возглавлявшаяся известным ученым Оствальдом, в основу теоретических воззрений которой было положено отвлеченное понятие энергии, не связанной с материей. Сторонники этой школы считали, что все внешние явления могут быть объяснены как процессы между энергиями, и категорически отвергали существование атомов и молекул, как недоступных непосредственному чувственному восприятию частиц.
Энергетическое учение Оствальда являлось одной из разновидностей идеалистических философских течений, направленных против материализма в науке. Отрывая энергию, т. е. движение от материи, допуская существование нематериального движения, последователи Оствальда тем самым молчаливо признавал, что наше сознание, мысль, ощущения существуют самостоятельно, как нечто первичное, не связанное с материей. Химические элементы рассматривались ими не как определенные , а как различные формы химической энергии.
Реакционная сущность учения Оствальда была блестяще вскрыта В. И. Лениным в его труде «Материализм и эмпириокритицизм». В гл. V этого труда, говоря о связи философского идеализма с некоторыми новыми течениями в физике, Ленин останавливается и на «философии» Оствальда, доказывает всю ее несостоятельность и неизбежность ее поражения в борьбе с материализмом.
«…попытка мыслить движение без материи, - пишет Ленин, - протаскивает мысль, оторванную от материи, а это и есть философский идеализм» .
Ленин не только полностью вскрыл идеалистическую основу оствальдовских рассуждений, но и показал содержащиеся в них внутренние противоречия. Выдвигая философскую идею о существовании движения без материи, Оствальд отвергает объективное существование материи, но в же время как физико-химик сам на каждом шагу трактует энергию материалистически, опираясь на закон сохранения и превращения энергии. «Превращение энергии, - констатирует Ленин, - рассматривается естествознанием как объективный процесс, независимый от сознания человека и от опыта человечества, т. е. рассматривается материалистически. И у самого Оствальда в массе случаев, даже вероятно в громадном большинстве случаев, под энергией разумеется материальное движение» .
Вскоре новые поразительные открытия, которыми ознаменовалось начало XX в., настолько неопровержимо доказали реальность атомов и молекул, что в конце концов даже Оствальд вынужден был признать их существование.
Из экспериментальных исследований, посвященных вопросу о существовании атомов и молекул, особенный интерес представляют работы французского физика Перрена по изучению распределения и движения частиц в так называемых суспензиях.
Приготовив суспензию, содержавшую частицы одинакового размера, видимые в микроскоп, Перрен исследовал распределе ние частиц в ней. В результате многочисленных опытов, проведенных с необычайной тщательностью, им было доказано, что распределение частиц суспензии по высоте в точности соответствует закону уменьшения концентрации газов с высотой, выведенному из кинетической теории газов. Таким образом, Перрен показал, что суспензии - это настоящие модели газов; следовательно, отдельные молекулы существуют и в газах, только они невидимы вследствие их малой величины.
Еще более убедительными оказались результаты, полученные Перреном при наблюдении движения частиц суспензии.
При рассмотрении капли жидкости с взвешенными в ней частицами в сильный микроскоп можно видеть, что частицы не остаются в покое, но непре рывно движутся во всевозможных направлениях. Движение частиц отличается крайней беспорядочностью. Если проследить под микроскопом путь отдельной частицы, получается очень сложная зигзагообразная линия, указывающая на отсутствие всякой закономерно-ти в движении частиц (рис. 8). Это движение может продолжаться сколько угодно времени, не ослабевая и не изменяя своего характера.
Описываемое явление было открыто в 1827 г. английским ботаником Броуном и получило название броуновского движения. Однако объяснение ему было дано только в 60-х годах на основе молекулярно-кинетических представлений. Согласно этому объяснению, причиной видимого движения частиц суспензии является невидимое тепловое движение окружающих их молекул жидкости. Толчки, получаемые частицами суспензии со всех сторон от молекул жидкости, не могут, конечно, в точности уравновешивать друг друга; в каждый момент равновесие нарушается в пользу того или иного направления, в результате чего частицы и совершают свой причудливый путь.
Таким образом, уже самый факт существования броуновского движения свидетельствует о реальности молекул и дает картину их беспорядочного движения, так как взвешенные частицы в общем повторяют те же движения, что и молекулы жидкости. Но Перрен в своих исследованиях пошел еще дальше: путем длительных наблюдений за движением частиц под микроскопом ему удалось определить среднюю скорость перемещения частиц. Отсюда, зная массу частиц приготовленной суспензии, Перрен вычислил их среднюю кинетическую энергию. Результат получился поразительный. Оказалось, что кинетическая энергия частиц как раз соответствует кинетической энергии молекул газа, вычисленной для той же температуры на основании, кинетической теории. Частицы Перрена были примерно в 10 12 раз тяжелее молекул водорода, кинетическая же энергия тех и других одинакова. После установления этих фактов уже невозможно было отрицать объективную реальность молекул.
В настоящее время броуновское движение рассматривается и как следствие теплового движения молекул жидкости и как самостоятельное тепловое движение частиц суспензии. Последние представляют собой как бы молекулы-гиганты, участвующие в тепловом движении наравне с невидимыми молекулами жидкости. Никакого принципиального различия между теми и другими не существует.
Опыты Перрена не только доказали, что молекулы действительно существуют, но и дали возможность рассчитать число молекул в одной граммолекуле газа. Это число, имеющее, как мы знаем, универсальное значение, получило название числа Авогадро. По вычислениям Перрена, оно оказалось равным приблизительно 6,5 10 23 , что очень близко подходило к значениям этой величины, найденным ранее другими способами. Впоследствии число Авогадро много раз определялось совершенно различными физическими методами, причем результаты всегда получались очень близкими. Такое совпадение результатов свидетельствует о правильности найденного числа и служит неоспоримым доказательством реального существования молекул.
В настоящее время число Авогадро принимается равным
6,02 10 23
Колоссальная величина числа Авогадро выходит за пределы нашего воображения. Некоторое представление о ней можно составить только путем сравнений.
Положим, например, что 1 моль, т. е. 18 г, воды равномерно распределен по всей поверхности земного шара. Простой подсчет показывает, что на каждый квадратный сантиметр поверхности придется около 100 000 молекул.
Приведем еще другое сравнение. Допустим, что нам удалось каким-то способом пометить все молекулы, содержащиеся в 18 г воды. Если затем вылить эту воду в море и дождаться, чтобы она равномерно перемешалась со всеми водами земного шара, зачерпнув в любом месте стакан воды, мы найдем в нем около 100 отмеченных нами молекул.

Рис. 9. Частицы дыма окиси цинка при увеличении в 20 000 раз
Так как граммолекула любого газа занимает при нормальных условиях объем 22,4 л, то в 1 мл газа содержится при этих условиях 2,7 10 19 молекул. Если довести разрежение газа в каком-нибудь сосуде даже до крайнего предела, которого позволяют достигнуть наилучшие насосы (приблизительно до одной десятимиллиардной доли атмосферы), т. е. получить то, что мы практически считаем «безвоздушным пространством», то все-таки в 1 см 3 этого пространства молекул остаётся значительно больше, чем всех людей на земном шаре. По этому можно судить, как ничтожны должны быть размеры молекул и атомов, если столь огромное число их умещается в 1 см 3 . И тем не менее физики различными способами вычислили эти размеры. Оказывается, что если представить себе молекулы в виде крошечных шариков, то диаметр их будет измеряться стомиллионными долями сантиметра. Например, диаметр молекулы кислорода равняется приблизительно 3,2 10 -8 см, диаметр молекулы водорода 2,6 10 -8 см и диаметр атома водорода 1 10 -8 см.
Для выражения таких малых величин очень удобно принять за единицу длины одну стомиллионную долю сантиметра (10 -8 см). Эта единица была предложена шведским физиком Ангстремом для измерения длин световых волн и по его имени названаангстремом. Обозначается она символом А или А. Линейные размеры атомов и молекул выражаются обычно несколькими ангстремами.
Зная число молекул в одной граммолекуле, а следовательно, й число атомов в одном грамматоме, можно рассчитать вес атома любого элемента в граммах. Например, разделив грамматом водорода на число Авогадро, получим вес атома водорода в граммах:
Альберт Эйнштейн
Нередко заслугой Альберта Эйнштейна считают лишь создание теории относительности. С точки зрения истории науки такая оценка неверна и несправедлива по отношению к его замечательным достижениям в других областях физики. "Отец теории относительности" был ученым с исключительно многосторонними интересами.
В бернские годы, во времена самой бурной творческой активности Эйнштейна, почти одновременно появились на свет первые результаты его исследований, имевшие огромное значение для дальнейшего развития физики. Особенно плодотворным оказался 1905 год, когда Эйнштейну было 26 лет. Хронологически первыми были его исследования по молекулярной физике.
Работы Эйнштейна по тепловому движению посвящены главным образом проблеме статистического описания движения атомов и молекул и взаимосвязи между движением и теплотой. В этих работах Эйнштейн пришел к выводам, существенно расширяющим результаты, полученные гениальным австрийским физиком Людвигом Больцманом и американцем Уиллардом Гиббсом. Основная заслуга Эйнштейна заключалась не столько в преодолении математических трудностей, сколько в более глубокой постановке физических вопросов. Он руководствовался при этом идеей Больцмана о том, что в основе математической трактовки учения о теплоте должно лежать понятие вероятности ("принцип Больцмана").
Все эти вопросы были разработаны Эйнштейном самостоятельно, поэтому мы имеем право вместе с Максом Борном говорить о том, что "Эйнштейн открыл заново все существенные черты статистической механики". Молодой исследователь принялся за свои работы по молекулярной физике с твердым намерением подтвердить надежными результатами атомистическую теорию, в правильности которой он был убежден, хотя тогда она многим казалась спорной.
В центре внимания Эйнштейна в его исследовательской работе по теории теплоты находилось броуновское молекулярное движение. В 1827 году английский ботаник Роберт Броун проводил наблюдения цветочной пыльцы под микроскопом; при этом он обнаружил, что взвешенные в капле жидкости частички непрерывно совершают беспорядочные, зигзагообразные движения. Такое движение частиц - позднее названное по имени открывшего его ученого "броуновским движением" - происходит тем интенсивнее, чем меньше масса частиц и чем теплее жидкость, в которой они находятся.
В течение ряда десятилетий ученые безуспешно пытались найти объяснение этому загадочному явлению. В 1880-х годах - за два десятилетия до Эйнштейна - один французский физик предположил, что броуновское движение является результатом беспорядочных ударов, которые испытывают взвешенные частицы со стороны невидимых под микроскопом молекул жидкости. Однако это остроумное объяснение не имело ни математического обоснования, ни экспериментального подтверждения.
В статье "О движении взвешенных в покоящейся жидкости частиц, вытекающем из молекулярно-кинетической теории", Эйнштейн с помощью статистических методов показал, что между скоростью движения взвешенных частиц, их размерами и коэффициентом вязкости используемой жидкости существует количественная взаимосвязь, которая может быть экспериментально проверена.
Эйнштейн, который тогда еще не был знаком с предшествовавшими работами по броуновскому движению, считал, что движение видимых под микроскопом частиц представляет собой проявление движения микроскопически невидимых молекул жидкости. Эйнштейн придал законченную математическую форму статистическому объяснению этого явления, уже сформулированному до него польским физиком Марианом фон Смолуховским. "Эйнштейновский закон броуновского движения" был полностью подтвержден в 1908 году опытами французского физика Жана Перрена, получившего за эти работы в 1926 году Нобелевскую премию.
Работы Эйнштейна по молекулярной физике доказали правильность представления о том, что теплота есть форма энергии неупорядоченного движения молекул. Одновременно они подкрепили атомистическую гипотезу, согласно которой материя - в физическом понимании - состоит из молекул и атомов.
Предложенный Эйнштейном метод определения размеров молекул и его формула для броуновского движения позволяют определить число молекул. До этого физики были вынуждены обходиться приближенными способами, предложенными в 1865 году австрийским физиком Лошмидтом; теперь же благодаря исследованиям Эйнштейна они могли оперировать точными математическими методами.
Наряду с чисто научной ценностью исследования Эйнштейна по тепловому движению имели большое теоретико-познавательное значение. Они показали, что отрицательное или скептическое отношение некоторых естествоиспытателей к атомистической теории ничем не оправдано. Полученное Эйнштейном доказательство правильности атомистических воззрений было настолько убедительным, что химик Вильгельм Оствальд, который до этого вместе с Эрнстом Махом был упорным противником учения об атомах, теперь, по его собственным словам, "был обращен в атомную веру".
Решающий вклад, который Эйнштейн внес в победу атомистики, следует считать одной из его величайших научных заслуг. В этом он является достойным преемником великих материалистов античности: Демокрита, Эпикура и Лукреция.
Фридрих Гернек, 1984 год
Теория Дж. Дальтона
Первым действительно научным обоснованием атомистической теории, убедительно продемонстрировавшим рациональность и простоту гипотезы о том, что всякий химический элемент состоит из мельчайших частиц, явилась работа английского школьного учителя математики Дж.Дальтона (1766-1844), статья которого, посвященная этой проблеме, появилась в 1803. Атомные постулаты Дальтона имели то преимущество перед абстрактными рассуждениями древнегреческих атомистов, что его законы позволяли объяснить и увязать между собой результаты реальных опытов, а также предсказать результаты новых экспериментов. Он постулировал, что: 1) все атомы одного и того же элемента тождественны во всех отношениях, в частности, одинаковы их массы; 2) атомы разных элементов имеют неодинаковые свойства, в частности, неодинаковы их массы; 3) в соединение, в отличие от элемента, входит определенное целое число атомов каждого из составляющих его элементов; 4) в химических реакциях может происходить перераспределение атомов, но ни один атом не разрушается и не создается вновь. (В действительности, как выяснилось в начале 20 в., эти постулаты не вполне строго выполняются, т.к. атомы одного и того же элемента могут иметь разные массы, например водород имеет три такие разновидности, называемые изотопами; кроме того, атомы могут претерпевать радиоактивные превращения и даже полностью разрушиться, но не в химических реакциях, рассматривавшихся Дальтоном.) Основанная на этих четырех постулатах атомная теория Дальтона давала самое простое объяснение законов постоянных и кратных отношений. Однако она не давала никаких представлений о строении самого атома.
Броуновское движение
Шотландский ботаник Роберт Броун в 1827 году проводил исследования пыльцы растений. Он, в частности, интересовался, как пыльца участвует в процессе оплодотворения. Как-то он разглядывал под микроскопом выделенные из клеток пыльцы взвешенные в воде удлиненные цитоплазматические зерна. Неожиданно Броун увидел, что мельчайшие твердые крупинки, которые едва можно было разглядеть в капле воды, непрерывно дрожат и передвигаются с места на место. Он установил, что эти движения, по его словам, «не связаны ни с потоками в жидкости, ни с ее постепенным испарением, а присущи самим частичкам». Наблюдавшееся Броуном явление назвали «броуновским движением». Объяснение броуновского движения движением невидимых молекул было дано только в последней четверти XIX в., но далеко не сразу было принято всеми учеными. В 1863 году преподаватель начертательной геометрии Людвиг Кристиан Винер (1826-1896) предположил, что явление связано с колебательными движениями невидимых частиц.
Открытие электрона
Реальное существование молекул было окончательно подтверждено в 1906 году опытами по изучению закономерностей броуновского движения французского физика Жана Перрена.
В период, когда Перрен выполнял свои исследования катодных и рентгеновских лучей, еще не было выработано единого мнения относительно природы катодных лучей, испускаемых отрицательным электродом (катодом) в вакуумной трубке при электрическом разряде. Некоторые ученые полагали, что эти лучи представляют собой разновидность светового излучения, однако в 1895 году исследования Перрена показали, что они являются потоком отрицательно заряженных частиц. Атомная теория утверждала, что элементы составлены из дискретных частиц, называемых атомами, и что химические соединения состоят из молекул, частиц большего размера, содержащих два или более атомов. К концу XIX в. атомная теория получила широкое признание среди ученых, особенно среди химиков. Однако некоторые физики полагали, что атомы и молекулы - это не более чем фиктивные объекты, которые введены из соображения удобства и полезны при численной обработке результатов химических реакций.
Джозеф Джон Томсон, модифицировав эксперимент Перрена, подтвердил его выводы и в 1897 году определил важнейшую характеристику этих частиц, измерив отношение их заряда к массе по отклонению в электрическом и магнитном полях. Масса оказалась примерно в 2 тыс. раз меньше массы атома водорода, легчайшего среди всех атомов. Вскоре стало распространяться мнение, что эти отрицательные частицы, названные электронами, представляют собой составную часть атомов.
Горы, звезды, люди - все, что мы видим вокруг, состоит из крошечных атомов. Атомы маленькие. Очень и очень. С детства мы знаем, что все вещество состоит из скоплений этих крошечных штучек. Также мы знаем, что их нельзя увидеть невооруженным глазом. Мы вынуждены слепо верить этим заявлениям, не имея возможности проверить. Атомы взаимодействуют друг с другом и по кирпичикам составляют наш мир. Откуда мы это знаем? Многие не любят принимать утверждения ученых за чистую монету. Давайте вместе с наукой пройдем путь от осознания атомов до непосредственного доказательства их существования.
Может показаться, что есть простой способ доказать существование атомов: засунуть их под микроскоп. Но этот подход не сработает. Даже самые мощные микроскопы, фокусирующие свет, не могут визуализировать один атом. Объект становится видимым, поскольку отражает световые волны. Атомы настолько меньше длины волны видимого света, что они вовсе не взаимодействуют. Иными словами, атомы невидимы даже для света. Однако атомы все же оказывают наблюдаемые эффекты на некоторые вещи, которые мы можем увидеть.

Сотни лет назад, в 1785 году, голландский ученый Ян Ингенхауж изучал странное явление, которое не мог понять. Мельчайшие частицы угольной пыли шныряли на поверхности какого-то спирта в его лаборатории.
50 лет спустя, в 1827 году, шотландский ботаник Роберт Броун описал нечто удивительно похожее. Изучая пыльцевые гранулы под микроскопом, Броун обнаружил, что некоторые гранулы испускают крошечные частицы - которые затем удалялись от пыльцы в случайном нервном танце.
Сначала Броун подумал, что частицы были каким-то неизвестным организмом. Он повторил эксперимент с другими субстанциями, вроде каменной пыли, которая явно была неживой, и снова увидел странное движение.
Потребовалось почти сто лет, чтобы наука нашла объяснение. Пришел Эйнштейн и разработал математическую формулу, которая предсказывала тот самый особенный тип движения - тогда названный броуновским движением, в честь Роберта Броуна. Теория Эйнштейна заключалась в том, что частицы пыльцевых гранул постоянно перемещались, поскольку в них врезались миллионы крошечных молекул воды - молекул, состоящих из атомов.
«Он объяснил, что это нервное движение, которое вы наблюдаете, на самом деле вызывалось воздействием отдельных молекул воды на частички пыли или что там у вас есть», - объясняет Гарри Клифф из Кембриджского университета, также куратор Музея науки в Лондоне.
К 1908 году наблюдения, подкрепленные расчетами, показали, что атомы реальны. За десять лет физики существенно продвинулись вперед. Растягивая отдельные атомы, они начали понимать их внутреннюю структуру.
Сюрпризом стало то, что атомы можно разделить - особенно в свете того, что само название «атом» вышло из греческого «атомос», означающего «неделимый». Но физики теперь знают, что атомы далеко не базовые кирпичи. Они состоят из трех основных частей: протонов, нейтронов и электронов. Представьте, что протоны и нейтроны вместе образуют «солнце», или ядро, в центре системы. Электроны находятся на орбите этого ядра, подобно планетам.

Если атомы невообразимо малы, то эти субатомные частицы и вовсе. Забавно, но первой обнаружили самую малую частицу из трех - электрон. Чтобы понять разницу размеров, имейте в виду, что протоны в ядре в 1830 раз больше электрона. Представьте себе чупа-чупс на орбите воздушного шара - несоответствие будет примерно таким.
Но как мы узнали, что эти частицы там? Ответ в том, что они хоть и маленькие, но имеют большое влияние. Британский физик Томсон, открывший электроны, использовал прекрасный метод, чтобы доказать их существование в 1897 году.
У него была трубка Крукса - кусок стекла смешной формы, из которого машиной был высосан почти весь воздух. К одному концу трубки подводили отрицательный электрический заряд. Этого заряда было достаточно, чтобы выбить у молекул оставшегося в трубке газа часть электронов. Электроны заряжены отрицательно, поэтому летели к другому концу трубки. Благодаря частичному вакууму, электроны пролетали через трубку, не встречая на своем пути крупные атомы.
Электрический заряд приводил к тому, что электроны двигались очень быстро - порядка 59 500 километров в секунду - пока не врезались в стекло на дальнем конце, выбивая еще больше электронов, которые прятались в его атомах. Удивительно, но столкновение между этими умопомрачительно крошечными частицами производило столько энергии, что порождало фантастическое зелено-желтое свечение.

«Это был в некотором смысле один из первых ускорителей частиц, - говорит Клифф. - Он ускоряет электроны на одном конце трубки к другому, и они врезаются в экран на другом конце, производя фосфоресцирующее свечение».
Поскольку Томсон обнаружил, что может управлять пучками электронов с помощью магнитов и электрических полей, он знал, что это были не просто странные лучи света, - это были заряженные частицы.
И если вам интересно, как эти электроны могут летать независимо от своих атомов, то это благодаря процессу ионизации, в котором - в данном случае - электрический заряд меняет структуру атома, выбивая электроны в пространство поблизости.
В частности, благодаря тому что электронами так просто манипулировать и двигать, стали возможны электрические схемы. Электроны в медном проводе движутся подобно поезду от одного атома меди к другому - потому-то провод передается по проводу. Атомы, как мы уже сказали, это не цельные кусочки вещества, а системы, которые можно модифицировать или разобрать на структурные элементы.

Открытие электрона показало, что нужно узнать об атомах побольше. Работа Томсона показала, что электроны отрицательно заряжены - но он знал, что атомы сами по себе не имеют общего заряда. Он предположил, что они должны содержать загадочные положительно заряженные частицы, чтобы компенсировать отрицательно заряженные электроны.
Начала 20 века выявили эти положительно заряженные частицы и в то же время раскрыли внутреннюю структуру атома - похожую на солнечную систему.
Эрнест Резерфорд и его коллеги взяли очень тонкую металлическую фольгу и поставили ее под луч положительно заряженного излучения - поток крошечных частиц. Большая часть мощного излучения прошла насквозь, как и полагал Резерфорд, учитывая толщину фольги. Но, к удивлению ученых, часть его отскочила.
Резерфорд предположил, что атомы в металлической фольге должны содержать небольшие плотные области с положительным зарядом - ничто иное не обладало бы достаточным потенциалом, чтобы отразить такое мощное излучение. Он обнаружил положительные заряды в атоме - и одновременное доказал, что все они связаны в плотной массе, в отличие от электронов. Другими словами, он продемонстрировал существование плотного ядра в атоме.
Оставалась проблема. К тому моменту уже могли рассчитать массу атома. Но учитывая данные о том, какими тяжелыми должны были быть частицы ядра, идея того, что все они положительно заряжены, не имела смысла.
«Углерод имеет шесть электронов и шесть протонов в ядре - шесть положительных зарядов и шесть отрицательных зарядов, - объясняет Клифф. - Но ядро углерода не весит шесть протонов, оно весит эквиваленту 12 протонов».
Сначала предположили, что в ядре есть шесть других ядерных частиц с массой протона, но заряженных отрицательно: нейтроны. Но никто не смог это доказать. На самом деле, нейтроны не могли найти до 1930-х годов.

Кембриджский физик Джеймс Чедвик отчаянно пытался открыть нейтрон. Он работал над этой теорией много лет. В 1932 году ему удалось осуществить прорыв.
За несколько лет до этого другие физики экспериментировали с радиацией. Они запускали положительно заряженное излучение - того типа, который использовал Резерфорд в поисках ядра - в атомы бериллия. Бериллий испускал собственную радиацию: излучение, которое не было заряжено положительно или отрицательно и могло проникать глубоко в материал.
К этому времени другие выяснили, что гамма-излучение было нейтральным и проникало глубоко, поэтому физики считали, что именно его испускают атомы бериллия. Но Чедвик так не считал.
Он самостоятельно произвел новое излучения и направил его на вещество, которое, как он знал, было богатым на протоны. Неожиданно оказалось, что протоны были выбиты из материала словно бы частицами с идентичной массой - будто шарики для бильярда другими шариками.
Гамма-излучение не может отражать протоны таким образом, поэтому Чедвик решил, что искомые частицы должны иметь массу протона, но другой электрический заряд: и это нейтроны.
Все основные частицы атома были найдены, но на этом история не заканчивается.
Хотя мы узнали об атомах много больше, чем знали раньше, их было трудно визуализировать. В 1930-х годах никто не располагал их снимками - и многие люди хотели их увидеть, чтобы принять их существование.
Важно отметить, впрочем, что методы, используемые учеными вроде Томсона, Резерфорда и Чедвика, проложили путь к новому оборудованию, которое в конце концов помогло нам произвести эти снимки. Пучки электронов, которые Томсон генерировал в своем эксперименте с трубкой Крукса, оказались особенно полезными.
Сегодня подобные пучки генерируются электронными микроскопами, и самый мощный из таких микроскопов может на самом деле делать снимки отдельных атомов. Это потому, что электронный пучок обладает длиной волны в тысячи раз короче пучка света - настолько короткой, по сути, что волны электронов могут отражаться от крошечных атомов и выдавать картинку, чего не могут световые пучки.
Нил Скиппер из Университетского колледжа в Лондоне говорит, что такие изображения полезны для людей, которые хотят изучать атомную структуру специальных веществ - вроде тех, что используются в производстве батарей для электромобилей, к примеру. Чем больше мы знаем об их атомной структуре, тем лучше нам удается проектировать батареи, делать их эффективными и надежными.
Можно также понять, как выглядят атомы, просто тыкнув в них. Так, по сути, работает атомно-силовая микроскопия.

Идея в том, чтобы поднести кончик чрезвычайно малого зонда к поверхности молекулы или вещества. При достаточной близости зонд будет чувствителен к химической структуре того, на что указывает, и изменение сопротивления по мере движения зонда позволит ученым произвести снимки, к примеру, отдельной молекулы.
Скиппер добавляет, что многие атомные ученые исследуют, как структура вещей меняется при воздействии высокого давления или температуры. Большинство людей знает, что когда вещество нагревается, оно часто расширяется. Теперь можно обнаружить атомные изменения, которые происходят при этом, что зачастую оказывается полезным.
«При нагревании жидкости можно заметить, как ее атомы принимают неупорядоченную конфигурацию, - говорит Скиппер. - Вы можете увидеть это непосредственно из структурной карты».
Скиппер и другие физики также могут работать с атомами, используя нейтронные пучки, впервые обнаруженые Чедвиком в 1930-х.
«Мы запускаем много пучков нейтронов в образцы материалов, и из возникающего паттерна рассеяния можно понять, что вы рассеиваете нейтроны в ядрах, - говорит он. - Можно грубо прикинуть массу и размер объекта, который просвечивался».
Но атомы не всегда просто находятся там, в стабильном состоянии, ожидая, пока их изучат. Иногда они распадаются - то есть являются радиоактивными.
Существует множество естественных радиоактивных элементов. Этот процесс генерирует энергию, которая легла в основу ядерной энергетики - и ядерных бомб. Физики-ядерщики, как правило, пытаются лучше понять реакции, при которых ядро проходит через фундаментальные изменения вроде этих.

Лаура Харкнесс-Бреннан из Ливерпульского университета специализируется на изучении гамма-лучей - типа излучения, испускаемого распадающимися атомами. Радиоактивный атом определенного типа испускает особую форму гамма-луча. Это значит, вы можете идентифицировать атомы, только регистрируя энергию гамма-лучей - этим, собственно, Харкнесс-Бреннан и занимается в своей лаборатории.
«Типы детекторов, которые вы должны использовать, представлены детекторами, которые позволят вам измерять одновременно присутствие излучения и энергии радиации, которая была отложена, - говорит она. - Все потому, что у всех ядер есть особый отпечаток».
Поскольку в области, где была обнаружена радиация, могут присутствовать все типы атомов, особенно после крупной ядерной реакции, важно точно знать, какие радиоактивные изотопы присутствуют. Такое обнаружение обычно проводится на ядерных станциях или в зонах, где произошла ядерная катастрофа.
Харкнесс-Бреннан и ее коллеги сейчас работают над системами обнаружения, которые можно разместить в таких местах, чтобы показать в трех измерениях, где может присутствовать радиация в конкретном помещении. «Вам нужны техники и инструменты, которые позволят составить трехмерную карту пространства и подскажут, где в этой комнате, в этой трубе радиация», - говорит она.
Также можно визуализировать излучение в «камере Вильсона». В рамках этого специального эксперимента охлажденный до -40 градусов по Цельсию спиртовый пар распыляется облаком над радиоактивным источником. Заряженные частицы радиации, летящие от источника излучения, выбивают электроны из молекул спирта. Спирт конденсируется в жидкость рядом с дорожкой излучаемых частиц. Результаты такого типа обнаружения впечатляют.
Мы мало работали непосредственно с атомами - разве что поняли, что это прекрасные сложные структуры, которые могут претерпевать удивительные изменения, многие из которых происходят в природе. Изучая атомы таким образом, мы улучшаем собственные технологии, извлекаем энергию из ядерных реакций и лучше понимаем природный мир вокруг нас. Мы также получили возможность защищать себя от радиации и изучать, как меняются вещества в экстремальных условиях.
«Учитывая, насколько мал атом, просто невероятно, как много физики мы можем извлечь из него», - метко подмечает Харкнесс-Бреннан. Все, что мы видим вокруг себя, состоит из этих мельчайших частиц. И хорошо знать, что они там есть, поскольку именно благодаря им все вокруг стало возможным.
По материалам BBC
Процесс познания складывается таким образом, что блестящие догадки и великие теории, появлению которых мы обязаны творческим гениям, через некоторое время становятся едва ли не тривиальными фактами, которые большинством людей принимается на веру. Многие ли из нас могли бы самостоятельно, на основе наблюдений и размышлений, догадаться, что Земля круглая или что Земля вращается вокруг Солнца, а не наоборот, и наконец, что существуют атомы и молекулы? С высоты современной науки основные положения атомно-молекулярной теории выглядят прописными истинами. Давайте, однако, отвлечемся от давно известных научных результатов, поставим себя на место ученых прошлого и попытаемся дать ответ на два главных вопроса. Во-первых, из чего состоят вещества? Во-вторых, почему вещества бывают разными и почему одни вещества могут превращаться в другие? На решение этих сложных вопросов наука уже потратила более 2 000 лет. В результате появилась атомно-молекулярная теория, основные положения которой можно сформулировать следующим образом.
- 1. Все вещества состоят из молекул. Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
- 2. Молекулы состоят из атомов. Атом - наименьшая частица элемента в химических соединениях. Разным элементам соответствуют разные атомы.
- 3. Молекулы и атомы находятся в непрерывном движении.
- 4. При химических реакциях молекулы одних веществ превращаются в молекулы других веществ. Атомы при химических реакциях не изменяются.
Как же ученые догадались о существовании атомов?
Атомы были придуманы в Греции в V в. до н. э. Философ Левкипп (500-440 до н. э.) задался вопросом, можно ли каждую частичку материи, какая бы малая она ни была, разделить на еще более мелкие частицы. Левкипп считал, что в результате такого деления можно получить настолько малую частицу, что дальнейшее деление станет невозможным.
Ученик Левкиппа философ Демокрит (460-370 до н. э.) назвал эти крошечные частицы «атомами» (атомос - неделимый). Он считал, что атомы каждого элемента имеют особые размеры и форму и что именно этим объясняются различия в свойствах веществ. Вещества, которые мы видим и ощущаем, образуются при соединении между собой атомов различных элементов, и, изменив природу этого соединения, можно одно вещество превратить в другое.
Демокрит создал атомную теорию почти в современном виде. Однако эта теория была лишь плодом философских размышлений, не связанных с природными явлениями и процессами. Она не была подтверждена экспериментально, поскольку древние греки вообще не проводили экспериментов, они ставили размышления выше наблюдений.
Первый эксперимент, подтверждающий атомную природу вещества, был проведен лишь спустя 2000 лет. В 1662 г. ирландский химик Роберт Бойль (1627-1691) при сжатии воздуха в U-образной трубке под давлением столбика ртути обнаружил, что объем воздуха в трубке обратно пропорционален давлению:
Французский физик Эдм Мариотт (1620-1684) подтвердил это соотношение через 14 лет после Бойля и заметил, что оно выполняется только при постоянной температуре.
Результаты, полученные Бойлем и Мариоттом, можно объяснить, только если признать, что воздух состоит из атомов, между которыми имеется пустое пространство. Сжатие воздуха обусловлено сближением атомов и уменьшением объема пустого пространства.
Если газы состоят из атомов, можно допустить, что твердые вещества и жидкости тоже состоят из атомов. Например, вода при нагревании кипит и превращается в пар, который, подобно воздуху, можно сжать. Значит, водяной пар состоит из атомов. Но если водяной пар состоит из атомов, почему жидкая вода и лёд не могут состоять из атомов? А если это справедливо для воды, это может быть справедливо и для других веществ.
Таким образом, эксперименты Бойля и Мариотта подтвердили существование мельчайших частиц вещества. Оставалось выяснить, что из себя представляют эти частицы.
В течение последующих 150 лет усилия химиков были направлены в основном на установление состава различных веществ. Вещества, которые разлагались на менее сложные вещества, были названы соединениями (сложными веществами), например вода, углекислый газ, железная окалина. Вещества, которые нельзя разложить, назвали элементами (простыми веществами), например водород, кислород, медь, золото.
В 1789 г. великий французский химик Антуан Лоран Лавуазье (1743-1794) опубликовал знаменитую книгу «Элементарный курс химии» (Traite elementaire de chimie), в которой систематизировал накопленные к тому времени знания по химии. В частности, он привел список всех известных элементов, который содержал 33 вещества. Два названия в этом списке были принципиально ошибочными (свет и теплород), а восемь оказались впоследствии сложными веществами (известь, кремнезём и другие).
Развитие техники количественных измерений и методов химического анализа позволило определять соотношение элементов в химических соединениях. Французский химик Жозеф Луи Пруст (1754-1826) после тщательных экспериментов с рядом веществ установил закон постоянства состава.
I Все соединения, независимо от способа получения, содержат эле- . менты в строго определенных весовых пропорциях.
Так, например, сернистый газ, получаемый сжиганием серы, действием кислот на сульфиты или любым другим способом, всегда содержит 1 весовую часть (массовую долю) серы и 1 весовую часть кислорода.
Оппонент Пруста, французский химик Клод Луи Бертолле (1748-1822), напротив, утверждал, что состав соединений зависит от способа их получения. Он считал, что, если в реакции двух элементов один из них взят в избытке, то и в образующемся соединении весовая доля данного элемента будет также больше. Пруст, однако, доказал, что Бертолле получил ошибочные результаты из-за неточного анализа и использования недостаточно чистых веществ.
Удивительно, но ошибочная для своего времени идея Бертолле в настоящее время положена в основу большого научного направления в химии - химического материаловедения. Главная задача материаловедов - получение материалов с заданными свойствами, а основной метод - использование зависимости состава, структуры и свойств материала от способа получения.
Закон постоянства состава, открытый Прустом, имел фундаментальное значение. Он привел к мысли о существовании молекул и подтвердил неделимость атомов. В самом деле, почему в сернистом газе S0 2 весовое (массовое) соотношение серы и кислорода всегда 1:1, а не 1,1: 0,9 или 0,95: 1,05? Можно предположить, что при образовании частицы сернистого газа (впоследствии эта частица была названа молекулой) атом серы соединяется с определенным числом атомов кислорода, причем масса атомов серы равна массе атомов кислорода.
А что происходит, если два элемента могут образовывать между собой несколько химических соединений? На этот вопрос дал ответ великий английский химик Джон Дальтон (1766-1844), который из эксперимента сформулировал закон кратных отношений (закон Дальтона).
I Если два элемента образуют между собой несколько соединений, то. в этих соединениях массы одного элемента, приходящиеся на единицу массы другого элемента, относятся как небольшие целые числа.
Так, в трех оксидах железа на единицу веса (массы) кислорода приходятся 3,5, 2,625 и 2,333 весовых частей (массовых долей) железа соответственно. Отношения этих чисел таковы: 3,5: 2,625 = = 4:3; 3,5: 2,333 = 3: 2.
Из закона кратных отношений следует, что атомы элементов соединяются в молекулы, причем молекулы содержат небольшое число атомов. Измерение массового содержания элементов позволяет, с одной стороны, определять молекулярные формулы соединений, а с другой - находить относительные массы атомов.
Например, при образовании воды одна весовая часть водорода соединяется с 8 весовыми частями кислорода. Если предположить, что молекула воды состоит из одного атома водорода и одного атома кислорода, окажется, что атом кислорода в 8 раз тяжелее атома водорода.
Рассмотрим обратную задачу. Мы знаем, что атом железа в 3,5 раза тяжелее атома кислорода. Из соотношения
следует, что в данном соединении на два атома железа приходится три атома кислорода, т. е. формула соединения - Fe 2 0 3 .
Рассуждая таким образом, Дальтон составил первую в истории таблицу атомных весов элементов. К сожалению, она оказалась во многих отношениях неверной, поскольку при определении атомных весов Дальтон часто исходил из неправильных молекулярных формул. Он считал, что атомы элементов почти всегда (за редким исключением) соединяются попарно. Формула воды по Дальтону - НО. Кроме того, он был уверен, что молекулы всех простых веществ содержат по одному атому.
Правильные формулы воды и многих других веществ были определены при исследовании химических реакций в газовой фазе. Французский химик Жозеф Луи Гей-Люссак (1778-1850) обнаружил, что один объем водорода реагирует с одним объемом хлора и получаются два объема хлороводорода; при электролитическом разложении воды образуются один объем кислорода и два объема водорода и т. д. Это эмпирическое правило было опубликовано в 1808 г. и получило название закона объемных отношений.
I Объемы реагирующих газов относятся друг к другу и к объемам газо- . образных продуктов реакции как небольшие целые числа.
Смысл закона объемных отношений выяснился после великого открытия итальянского химика Амедео Авогадро (1776-1856), сформулировавшего гипотезу (предположение), которая позднее была названа законом Авогадро.
| В равных объемах любых газов при постоянных температуре и дав- ? лении содержится одинаковое число молекул.
Это означает, что все газы ведут себя в некотором смысле одинаково и что объем газа при заданных условиях не зависит от природы (состава) газа, а определяется только числом частиц в данном объеме. Измеряя объем, мы можем определить число частиц (атомов и молекул) в газовой фазе. Великая заслуга Авогадро состоит в том, что он смог установить простую связь между наблюдаемой макроскопической величиной (объемом) и микроскопическими свойствами газообразных веществ (числом частиц).

Анализируя объемные соотношения, найденные Гей-Люссаком, и используя свою гипотезу (которую впоследствии назвали законом Авогадро), ученый установил, что молекулы газообразных простых веществ (кислорода, азота, водорода, хлора) двухатомные. Действительно, при реакции водорода с хлором объем не изменяется, следовательно число частиц также не изменяется. Если предположить, что водород и хлор одноатомны, в результате реакции присоединения исходный объем должен уменьшиться в два раза. Но после реакции объем не изменяется, значит, молекулы водорода и хлора содержат по два атома и реакция идет по уравнению
Аналогично можно установить молекулярные формулы сложных веществ - воды, аммиака, углекислого газа и других веществ.
Как это ни странно, но современники не оценили и не признали выводы, сделанные Авогадро. Ведущие химики того времени Дж. Дальтон и Йенс Якоб Берцелиус (1779-1848) возражали против предположения, что молекулы простых веществ могут быть двухатомные, поскольку полагали, что молекулы образуются только из разных атомов (положительно и отрицательно заряженных). Под давлением таких авторитетов гипотеза Авогадро была отвергнута и постепенно забыта.
Лишь почти через 50 лет, в 1858 г. итальянский химик Станислао Канниццаро (1826-1910) случайно обнаружил работу Авогадро и понял, что она позволяет четко разграничить понятия «атом» и «молекула» для газообразных веществ. Именно Канниццаро предложил определения атома и молекулы, которые приведены в начале данного параграфа, и внес полную ясность в понятия «атомный вес» и «молекулярный вес». В 1860 г. в г. Карлсруэ (Германия) состоялся Первый международный химический конгресс, на котором после долгих дискуссий основные положения атомно-молекулярной теории получили всеобщее признание.
Подведем итоги. В развитии атомно-молекулярного учения можно выделить три фундаментальных этапа.
- 1. Рождение атомного учения, появление идеи (гипотезы) о существовании атомов (Левкипп и Демокрит).
- 2. Первое экспериментальное подтверждение атомной теории в опытах со сжатым воздухом (закон Бойля-Мариотта).
- 3. Открытие важной закономерности о том, что в молекуле атомы разных элементов присутствуют в определенных весовых соотношениях (закон кратных отношений Дальтона), и установление формул газообразных простых веществ (гипотеза Авогадро).
Интересно, что, когда было высказано предположение о существовании атомов, теория была впереди эксперимента (сначала атомы были придуманы, а через 2000 лет это было доказано). В случае молекул эксперимент опередил теорию: идея существования молекул была выдвинута для объяснения экспериментального закона кратных отношений. В этом смысле история атомно-молекулярной теории - характерный пример, который отражает разные пути научных открытий.